
Rezept Tiramisu-Roulade lowcarb keto glutenfrei
15. August 2018
Die Wichtigkeit der Omega-3-Fettsäuren EPA und DHA
15. August 2018Ketogene Ernährung und ihre medizinischen Einsatzmöglichkeiten

Ketogene Ernährung und ihre medizinischen Einsatzmöglichkeiten
Dr. med. Vilmos Fux steht in diesem Beitrag über Ketogene Ernährung und ihre medizinischen Einsatzmöglichkeiten wieder für die Beantwortung einiger Fragen zur Verfügung.
Vilmos, könntest du uns ganz kurz erklären was Ketose ist und wie es dazu kommt?
Die Ketose findet immer dann statt, wenn über die Ernährung keine Kohlenhydrate in ausreichenden Mengen zugeführt werden. Dieser Zustand kann simuliert werden, indem man sich Fett-Eiweiß betont ernährt oder auch länger fastet. In der Ketose bezieht die Zelle ihre Energie einfach aus Fetten anstatt aus Kohlenhydraten.
Viele Mediziner erschrecken beim Begriff Ketose und raten oft Patienten von ketogenen Diäten dringend ab. Wo liegt aber der Unterschied zwischen der Ketose und der Ketoazidose?
Die Ketose ist ein völlig physiologischer, nicht krankhafter Prozess, der genauestens durch verschiedene Hormone reguliert wird und dem Menschen dient in Hunger- und Fastenzeiten den Körper mit ausreichend Energie zu versorgen, eben durch die Verbrennung von Fetten, die in Form von Ketonkörpern geliefert wird. Der Körper kann in diesem Fettverbrennungsmodus auch ewig funktionieren. Es wird immer behauptet, dass das Gehirn und die Erythrozyten, also die roten Blutkörperchen doch Glukose benötigen würden. Gehirnzellen können nach einer Adaptationsphase auch prima über Ketonkörper versorgt werden, sie arbeiten sogar effektiver. Die wenige Menge an Glukose, die von den Erythrozyten gebraucht wird, kann über die Glukoneogenese (die Herstellung von Glukose über die Bausteine von Eiweißen, also den Aminosäuren) in der Leber synthetisiert werden.
Die Ketoazidose hingegen kommt beim entgleisten Diabetes vor. Hier findet aufgrund der fehlenden Wirksamkeit des körpereigenen Insulins (oder komplett fehlenden Insulins) eine überschießende Produktion von Ketonkörpern statt, die zur metabolischen Azidose führt, ein medizinischer Notfall, der auch ins Koma führen und tödlich enden kann. Ein gesunder Mensch kann durch ketogene Ernährung niemals in eine pathologische Ketoazidose kommen!
 Warum und wann genau hat die ketogene Kost medizinisch betrachtet einen Sinn?
Warum und wann genau hat die ketogene Kost medizinisch betrachtet einen Sinn?
Es gibt zum Glück immer Fortschritte in der Medizin und ein neues Gebiet nennt sich „Mitochondriale Medizin“. Wir sind hier zwar erst am Anfang und das Thema ist hochkomplex und wir wissen noch nicht ganz genau wie es funktioniert, aber die Idee dahinter ist, dass nahezu alle chronischen Erkrankungen, inklusive Krebs, auch auf eine gestörte Funktion der Zelle beruht effizient Energie bereitzustellen. Energie ist notwendig für Leistung und Reparaturfunktionen. Nur die Umstellung von der Kohlenhydratverbrennung auf die Fettverbrennung scheint diesen Defekt (zusammen mit Lebensstilveränderungen) umkehren zu können. Diese Ernährung muss auch sehr nährstoffreich sein. Aus Gründen die wir noch nicht genau wissen ist dieser Zustand manchmal auch dauerhaft notwendig (Epilepsie oder Krebs). Die Ursache dieser Fehlfunktion ist multifaktoriell: Nährstoffmangel, schwerer langer Kalorienmangel, Schlafmangel, Bewegungsmangel, mechanische und psychische Traumata, chronische Überstressung, Rauchen, Elektrosmog, toxische Chemikalien (Umweltgifte) und manche Medikamente. Eine korrekte intensive Anamnese und Labortestung ist somit nicht umgehbar. Bei der Mitochondrialen Medizin überlappen sich die Gebiete der Medizin, Biologie, Biochemie und der (Quanten-) Physik. Mitochondrien sind Zellorganellen und kurz gesagt die „Kraftwerke“ der Zelle.
1) Krebs
Viele Tumorzellen weisen einen gestörten Stoffwechsel auf und benötigen Glukose zum proliferieren (wachsen). Setzt man diese Tumorzellen einer Umgebung aus wo wenig Glukose (Kohlenhydrate) zur Verfügung stehen wie es bei einer ketogenen Kost der Fall ist, können die Mitochondrien keine Energie mehr bereitstellen. Als Konsequenz können die Tumorzellen nicht mehr wachsen und sterben ab. Ob ein Tumor Glukose abhängig ist, zeigt sich durch einen PET-SCAN.
Erste Studien belegen, dass die ketogene Kost die Nebenwirkungen schulmedizinischer Krebstherapien senken und diese sogar effektiver machen können. Leider scheinen Lymphome und Leukämien resistent gegenüber ketogenen Diäten zu sein. Es gibt auch neuere Hinweise, dass eine LowCarb-Kost ausreicht und sie nicht mehr so drastisch kohlenhydratreduziert sein muss wie die ketogene Kost um erste gute Ergebnisse zu erzielen.
2) Epilepsie und neurologische Erkrankungen
Dass die ketogene Kost bei medikamentenresistenten und nicht operablen Epilepsien vor allem bei Kindern hervorragende Ergebnisse erzielen kann ist eigentlich schon seit dem letzten Jahrhundert bekannt. Man beobachtete, dass Epileptiker im Fastenzustand weniger oder gar keine Anfälle mehr hatten. Nach einer Adaptationsphase bedeutet die Verbrennung von Ketonkörpern für die Nervenzelle weniger oxidativen Stress und sie arbeitet sogar effektiver.
Weitere neurologische Erkrankungen die von einer ketogenen Kost profitieren sind MS, ALS, Parkinson, Alzheimer, Kopfschmerzen, Migräne, Schlafstörungen und Autismus.
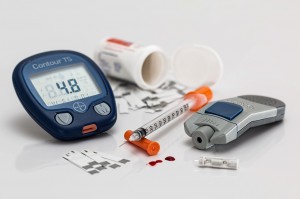 3) Diabetes
3) Diabetes
Beim Diabetes führt eine ketogene Kost zur Reduktion der blutzuckersenkenden Medikamente und des Insulinbedarfs, zu Gewichtsverlust und wenn früh genug begonnen – zur kompletten Medikamentenelimination. Wer weniger Kohlenhydrate über die Ernährung zuführt braucht als logische Konsequenz weniger Medikamente, die den Blutzuckerspiegel senken oder die übrig gebliebene Insulinproduktion der Bauchspeicheldrüse steigern. Der Tagesblutzuckerspiegel bleibt nämlich konstant.
Als man noch kein Insulin aus Tieren gewinnen konnte oder synthetisch herstellen konnte, diente die ketogene Kost noch bis ca. zum 1. Weltkrieg als einzige mögliche Therapie des Diabetes.
Wer an insulinpflichtigem Diabetes leidet und auf eine ketogene Kost umsteigt muss unbedingt eine Medikamentenadaptierung mit seinem Arzt besprechen um mögliche gefährliche Hypoglykämien (Unterzuckerungen) zu vermeiden.
4) Übergewicht bis sehr schweres Übergewicht (Adipositas)
Die ketogene Kost hält über den erhöhten Eiweißgehalt in der Ernährung länger satt, eliminiert Heißhungerattacken und man isst automatisch weniger ohne Kalorien zu zählen oder Lebensmittel abzuwiegen. Eiweiße benötigen im Gegensatz zu Kohlenhydraten oder Fetten auch mehr Energie um verdaut zu werden. Man verbraucht also allein durch deren Verdauung auch automatisch mehr Kalorien.
5) Risikofaktoren für Herzkreislauferkrankungen
Eine ketogene Kost verbessert, wenn man die richtigen Fette zu sich nimmt, sogar die Blutwerte: Es erfolgt ein Shift von den stark artherogenen LDL Partikeln zu den weniger artherogenen LDL Partikeln, bei gleichzeitiger Erhöhung von HDL, dem im Volksmund bekannten „guten Cholesterin“. Eine erhöhte Zufuhr von Cholesterin über die Ernährung erhöht nicht das Risiko für Herzkreislauferkrankungen im Gegenteil: Es verbessert oft sogar das LDL/HDL Verhältnis. Wenn man mehr Cholesterin über die Ernährung aufnimmt, produziert die Leber einfach weniger, welche sowieso über 90% des Gesamtcholesterins synthetisiert.
Des Weiteren senkt die ketogene Kost den Blutdruck, die Triglyceride und verbessert den HbA1c Wert.
6) Polyzystisches Ovarialsyndrom (PZOS)
Das PZOS hat metabolische Ursachen und geht oft mit dem Diabetes Hand in Hand. Aus diesem Grunde ist die ketogene Kost auch hier zu empfehlen.
7) Akne
Die Ketogene Kost ist, richtig durchgeführt, nährstoffreicher als die konventionelle stark Getreide-betonte Kost und ist reicher an hochqualitativem Eiweiß. Sie enthält viele gute Ballaststoffe, die einen positiven Effekt auf die Darmflora haben. Insgesamt führt dies zu einer Besserung des Hautbildes. Eine gesunde Haut kommt von Innen und nicht von Außen!
8) Glutenintoleranz
Zufällig ist die ketogene Kost auch von Natur aus glutenfrei und somit werden auch komplett alle intestinalen und oft maskierten extraintestinalen Symptome der Zöliakie, Nicht-Zöliakie-Glutensensitivität und Weizenallergie therapiert.
9) Gicht
Die Gicht kommt nicht von zu viel Fleischkonsum. Man hat das zwar lange gedacht, aber auch dies wurde revidiert. Auch die Gicht beruht auf einem gestörten Stoffwechsel. Die erhöhte tierische Proteinzufuhr (die viele Purine enthält), erhöht die Ausscheidung von Harnsäure, während die Kohlenhydratreduktion (vor allem die Reduktion von Fruktose) kehrt die Stoffwechselstörung um. Man darf bloß nicht viele Purine mit vielen Kohlenhydraten kombinieren solange man Gicht hat, das führt nämlich zu Gichtanfällen. Nur Stoffwechselgesunde können sich das leisten. Zusätzlich ist die Reduktion von Alkohol dringend einzuhalten.
10) Lungenerkrankungen
Patienten mit COPD, chronischer Bronchitis und Lungenemphysemen profitieren ebenfalls von einer ketogenen Kost.
9) Körperlich stark inaktive Leute
Wer einen sehr körperlich inaktiven Lebensstil praktiziert, dem empfiehlt es sich den ständigen Konsum von Kohlenhydraten mit Vorsicht zu genießen. Den ganzen Tag Kohlenhydrate zu essen ohne sich zu bewegen ist längerfristig eine Idealkonstellation für Übergewicht und chronischen Krankheiten.
Studien zeigen, dass die ketogene Kost im Ausdauersport sogar zu mehr Leistung bringt als Sportler, die dauernd Müsli, Nudeln, Reis und Kartoffeln zu sich nehmen. Schließlich liefert 1 Fettsäuremolekül der Zelle mehr Energie als 1 Glukosemolekül und nach einer Adaptionsphase läuft die Energiebereistellung sogar schneller ab. Je mehr Energie der Zelle pro Sekunde zur Verfügung steht, desto mehr kann sie leisten. Anders sieht es beim Kraftsport aus, aber auch hier gibt es auch Ausnahmen. Insulin hat nämlich eine stark natürliche anabole Wirkung und zu dessen vermehrten Ausschüttung kommt es gerade durch die Zufuhr von Kohlenhydraten.
Möchtest du noch etwas über die Qualität der Lebensmittel sagen?
Ketogene Diäten sind keine Fleischorgien. Die Qualität der Lebensmittel ist sehr wichtig: Fleisch nur Bio oder aus Weidehaltung. Weitere gute Eiweißquellen sind Fisch, Eier und hochwertige Milchprodukte. Hülsenfrüchte scheiden wegen ihrem Stärkegehalt aus.
Die Fettqualität spielt auch eine sehr wichtige Rolle: Die meisten Fette sollten gesättigt (z.B. Virgin Coconut Oil – VCO*) oder einfach ungesättigt (z.B. hochwertiges Olivenöl) sein. Die möglichen gesundheitsschädlichen Auswirkungen von gesättigten Fettsäuren sind schon längst überholt. Bei mehrfach ungesättigten Fettsäuren ist auf ein gutes Verhältnis von Omega 3 zu 6 zu achten, am besten 1:1 anzustreben.
 Um Ballaststoffe muss man sich auch keine Sorgen machen: Eine ketogene Kost bietet ausreichend Ballaststoffe aus nicht stärkehaltigem Gemüse und enthält sogar die besseren Ballaststoffe als Vollkorn, nämlich wasserlösliche Ballaststoffe. 2/3 des Tellers sollte Gemüse in allen Farben sein und es darf ruhig öfters auch mal gekocht sein, da es somit leichter verdaulich und darmschonender ist.
Um Ballaststoffe muss man sich auch keine Sorgen machen: Eine ketogene Kost bietet ausreichend Ballaststoffe aus nicht stärkehaltigem Gemüse und enthält sogar die besseren Ballaststoffe als Vollkorn, nämlich wasserlösliche Ballaststoffe. 2/3 des Tellers sollte Gemüse in allen Farben sein und es darf ruhig öfters auch mal gekocht sein, da es somit leichter verdaulich und darmschonender ist.
Zwar kann der Körper Ketonkörper aus allen Fetten bilden, allerdings gelingt dies bei mittelkettigen Triglyceriden, die wir im VCO* (und übrigens auch in der Muttermilch) finden am effektivsten und sollte wenn möglich den Hauptanteil der gesättigten Fetten ausmachen. Wer eine Unverträglichkeit zu Kokos hat, kann auch MCT-Öl kaufen. Die MCTs reparieren übrigens mitochondrale Dysfunktionen effektiver als andere Fettsäuren!
Wie man am besten gute Fette in der Ernährung „reinbasteln“ kann, ohne dass es im Teller rumschwimmt und man diese schmackhaft zu sich führt, findet ausreichend gesunde und sehr nährstoffreiche Rezepte hier im Blog. Man muss heute dabei gar nicht mehr auf Brot oder Kuchen verzichten. Eine Lowcarb/Ketogene Kost lässt sich heute super gut im Alltag integrieren und man muss auf gar nichts mehr wirklich verzichten, es lässt sich alles nachbauen, wer dies unbedingt möchte und das ohne hoch industriell verarbeitete Lebensmittel verwenden zu müssen und es schmeckt prima.
In manchen Kreisen, vor allem jenen, die stark gegen die ketogene Kost sind, zirkuliert die Hypothese, dass eine Ketogene Kost zu Schilddrüsenunterfunktionen führt. Dies ist nicht ganz korrekt. Die ketogene Kost bringt eine subklinische Schilddrüsenunterfunktion nur zum Vorschein, die Erkrankung bestand aber schon vorher. Somit fällt die Empfehlung hier wieder erneut die Zufuhr von Kohlenhydraten zu steigern in die Kategorie Symptomunterdrückung. Warum genau Schilddrüsenunterfunktionen manifest werden wissen wir noch nicht genau, eine Hypothese ist die nicht ausreichende Versorgung der Schilddrüse mit der tierischen Omega 3 Fettsäure DHA.
Ketogene Kostformen dienen somit schon seit langem nicht mehr nur der Gewichtsreduktion. Natürlich benötigen wir weitere Studien um die therapeutischen Hinweise besser zu belegen und die Mechanismen genauer zu verstehen.
 Wer mit einer ketogenen Kost beginnen möchte empfehle ich immer vorher einen Arzt und/oder eine Diätologin zu konsultieren, die sich mit dieser Ernährungsform auskennen um eine individuell abgestimmte Ernährung zu finden, die sich für den Betroffenen auch im Alltag integrieren lässt und um korrekt informiert zu werden.
Wer mit einer ketogenen Kost beginnen möchte empfehle ich immer vorher einen Arzt und/oder eine Diätologin zu konsultieren, die sich mit dieser Ernährungsform auskennen um eine individuell abgestimmte Ernährung zu finden, die sich für den Betroffenen auch im Alltag integrieren lässt und um korrekt informiert zu werden.
Vielen Dank Vilmos für deinen spannenden Artikel und die zahlreichen Literaturhinweise – ich wünsch dir weiterhin alles Gute für deine Karriere. Ich freu mich schon auf weiter Informationen zum Thema Ernährung von dir!
HIER gehts zum früheren Gastbeitrag von Dr. Fux zum Thema Zöliakie/GLutenintoleranz .
Informationen zu den Inhalten der beiden Keto-Bücher (Keto-Basics und Keto-Info) findet man HIER. Was Dr. Ulrich Strunz dazu zu sagen hat findet man HIER.
Sie sind im Gesundheitsberuf tätig? Diätologin? Ernährungsmediziner? Sie wollen sich fundiert und umfassend fortbilden?
Hier geht´s zu mehr Information zur Fortbildung zum „Coach für ketogene Ernährung“ mit Mag. Julia Tulipan MSc und Daniela Pfeifer.
Sie wünschen eine ausführliche und persönliche Beratung zur Ketogenen Ernährung? HIER finden Sie alle Details dazu!
Dr.med. Vilmos Fux ist Ernährungsmediziner und Facharzt i.A. an der Medizinischen Universität Innsbruck. Dr. Fux ist auch in die Fortbildung von Ärzten und Diätologen an der Univ. Klinik Innsbruck involviert. Er leitete ausserdem im Rahmen seiner Diplomarbeit eine retrospektive Studie zum Thema „die Klinik der Glutenintoleranz im Erwachsenenalter“ an der Universitätsklinik Innsbruck und hält freiberuflich Seminare zum Thema Paleo, Beyond Paleo und Funktionelle Medizin sowohl in Österreich als auch in Deutschland überwiegend für Crossfit Boxen. Autor von „Klinik der Glutenintoleranz im Erwachsenenalter“ und „Keto-Info„.
- Atkins RC. Dr Atkins’ Diet Revolution: The High Calorie Way to Stay Thin Forever. D. McKay Co: New York, NY, USA, 1972.
- WHO. Medicines: Corruption and Pharmaceuticals. WHO Fact Sheet, WHO, 2009.
- Veech RL. The therapeutic implications of ketone bodies: The effects of ketone bodies in pathological conditions: ketosis, ketogenic diet, redox states, insulin resistance, and mitochondrial metabolism. Prostaglandins Leukot Essent Fatty Acids 2004; 70: 309–319.
- Owen OE, Morgan AP, Kemp HG, Sullivan JM, Herrera MG, Cahill GFJr. Brain metabolism during fasting. J Clin Invest 1967; 46: 1589–1595.
- Kessler SK, Neal EG, Camfield CS, Kossoff EH. Dietary therapies for epilepsy: future research. Epilepsy Behav 2011; 22: 17–22.
- Fukao T, Lopaschuk GD, Mitchell GA. Pathways and control of ketone body metabolism: on the fringe of lipid biochemistry. Prostaglandins Leukot Essent Fatty Acids 2004; 70: 243–251.
- Veldhorst MA, Westerterp-Plantenga MS, Westerterp KR. Gluconeogenesis and energy expenditure after a high-protein, carbohydrate-free diet. Am J Clin Nutr 2009; 90: 519–526.
- Krebs HA. The regulation of the release of ketone bodies by the liver. Adv Enzyme Regul 1966; 4: 339–354.
- Paoli A, Canato M, Toniolo L, Bargossi AM, Neri M, Mediati M et al. The ketogenic diet: an underappreciated therapeutic option? Clin Ter 2011; 162: e145–e153.
- Cahill GFJr. Fuel metabolism in starvation. Annu Rev Nutr 2006; 26: 1–22.
- Paoli A, Grimaldi K, Toniolo L, Canato M, Bianco A, Fratter A. Nutrition and acne: therapeutic potential of ketogenic diets. Skin Pharmacol Physiol 2012; 25: 111–117.
- Westerterp-Plantenga MS, Nieuwenhuizen A, Tome D, Soenen S, Westerterp KR. Dietary protein, weight loss, and weight maintenance. Annu Rev Nutr 2009; 29: 21–41.
- Feinman RD, Fine EJ. Nonequilibrium thermodynamics and energy efficiency in weight loss diets. Theor Biol Med Model 2007; 4: 27.
- Freedman MR, King J, Kennedy E. Popular diets: A scientific review. Obes Res 2001; 9 (Suppl 1), 1S–40S.
- Brehm BJ, Seeley RJ, Daniels SR, D’Alessio DA. A randomized trial comparing a very low carbohydrate diet and a calorie-restricted low fat diet on body weight and cardiovascular risk factors in healthy women. J Clin Endocrinol Metab 2003; 88: 1617–1623.
- Gardner CD, Kiazand A, Alhassan S, Kim S, Stafford RS, Balise RR et al. Comparison of the atkins, zone, ornish, and LEARN diets for change in weight and related risk factors among overweight premenopausal women: The A TO Z weight loss study: a randomized trial. JAMA 2007; 297: 969–977.
- Shai I, Schwarzfuchs D, Henkin , Shahar DR, Witkow S, Greenberg I et al. Weight loss with a low-carbohydrate, mediterranean, or low-fat diet. N Engl J Med 2008; 359: 229–241.
- Fine EJ, Feinman RD. Thermodynamics of weight loss diets. Nutr Metab (Lond) 2004; 1: 15.
- Halton TL, Hu FB. The effects of high protein diets on thermogenesis, satiety and weight loss: a critical review. J Am Coll Nutr 2004; 23: 373–385.
- Paoli A, Grimaldi K, Bianco A, Lodi A, Cenci L, Parmagnani A. Medium term effects of a ketogenic diet and a mediterranean diet on resting energy expenditure and respiratory ratio. BMC Proceedings 2012; 6, (Suppl 3): P37.
- Sumithran P, Prendergast LA, Delbridge E, Purcell K, Shulkes A, Kriketos A et al. Ketosis and appetite-mediating nutrients and hormones after weight loss. Eur J Clin Nutr 2013;, e-pub ahead of print 1 May 2013; doi:10.1038/ejcn.2013.90.
- Veldhorst M, Smeets A, Soenen S, Hochstenbach-Waelen A, Hursel R, Diepvens K et al. Protein-induced satiety: effects and mechanisms of different proteins. Physiol Behav 2008; 94: 300–307.
- Johnstone AM, Horgan GW, Murison SD, Bremner DM, Lobley GE. Effects of a high-protein ketogenic diet on hunger, appetite, and weight loss in obese men feeding ad libitum. Am J Clin Nutr 2008; 87: 44–55.
- Paoli A, Cenci L, Fancelli M, Parmagnani A, Fratter A, Cucchi A et al. Ketogenic diet and phytoextracts comparison of the efficacy of mediterranean, zone and tisanoreica diet on some health risk factors. Agro Food Ind Hi-Tech 2010; 21: 24.
- Nordmann AJ, Nordmann A, Briel M, Keller U, Yancy WSJr, Brehm BJ et al. Effects of low-carbohydrate vs low-fat diets on weight loss and cardiovascular risk factors: a meta-analysis of randomized controlled trials. Arch Intern Med 2006; 166: 285–293.
- Blackburn GL, Phillips JC, Morreale S. Physician’s guide to popular low-carbohydrate weight-loss diets. Cleve Clin J Med 2001; 68: 761–766. 768–9, 773–4.
- Volek JS, Phinney SD, Forsythe CE, Quann EE, Wood RJ, Puglisi MJ et al. Carbohydrate restriction has a more favorable impact on the metabolic syndrome than a low fat diet. Lipids 2009; 44: 297–309.
- Sharman MJ, Kraemer WJ, Love DM, Avery NG, Gomez AL, Scheett TP et al. A ketogenic diet favorably affects serum biomarkers for cardiovascular disease in normal-weight men. J Nutr 2002; 132: 1879–1885.
- Volek JS, Sharman MJ, Forsythe CE. Modification of lipoproteins by very low-carbohydrate diets. J Nutr 2005; 135: 1339–1342.
- Jornayvaz FR, Samuel VT, Shulman GI. The role of muscle insulin resistance in the pathogenesis of atherogenic dyslipidemia and nonalcoholic fatty liver disease associated with the metabolic syndrome. Annu Rev Nutr 2010; 30: 273–290.
- Hellerstein MK. De novo lipogenesis in humans: Metabolic and regulatory aspects. Eur J Clin Nutr 1999; 53 (Suppl 1), S53–S65.
- Bistrian BR, Blackburn GL, Flatt JP, Sizer J, Scrimshaw NS, Sherman M. Nitrogen metabolism and insulin requirements in obese diabetic adults on a protein-sparing modified fast. Diabetes 1976; 25: 494–504.
- Gumbiner B, Wendel JA, McDermott MP. Effects of diet composition and ketosis on glycemia during very-low-energy-diet therapy in obese patients with non-insulin-dependent diabetes mellitus. Am J Clin Nutr 1996; 63: 110–115.
- Boden G, Sargrad K, Homko C, Mozzoli M, Stein TP. Effect of a low-carbohydrate diet on appetite, blood glucose levels, and insulin resistance in obese patients with type 2 diabetes. Ann Intern Med 2005; 142: 403–411.
- Dashti HM, Al-Zaid NS, Mathew TC, Al-Mousawi M, Talib , Asfar SK et al. Long term effects of ketogenic diet in obese subjects with high cholesterol level. Mol Cell Biochem 2006; 286: 1–9.
- Yancy WSJr, Foy M, Chalecki AM, Vernon MC, Westman EC. A low-carbohydrate, ketogenic diet to treat type 2 diabetes. Nutr Metab (Lond) 2005; 2: 34.
- Nielsen JV, Joensson EA. Low-carbohydrate diet in type 2 diabetes: Stable improvement of bodyweight and glycemic control during 44 months follow-up. Nutr Metab (Lond) 2008; 5: 14.
- Basu S, Yoffe P, Hills N, Lustig RH. The relationship of sugar to population-level diabetes prevalence: An econometric analysis of repeated cross-sectional data. PLoS One 2013; 8: e57873.
- Hartman AL, Gasior M, Vining EP, Rogawski MA. The neuropharmacology of the ketogenic diet. Pediatr Neurol 2007; 36: 281–292.
- McDaniel SS, Rensing NR, Thio LL, Yamada KA, Wong M. The ketogenic diet inhibits the mammalian target of rapamycin (mTOR) pathway. Epilepsia 2011; 52: e7–e11.
- Hartman AL, Lyle M, Rogawski MA, Gasior M. Efficacy of the ketogenic diet in the 6-hz seizure test. Epilepsia 2008; 49: 334–339.
- Kossoff E. The fat is in the fire: ketogenic diet for refractory status epilepticus. Epilepsy Curr 2011; 11: 88–89.
- Cordain L, Eaton SB, Sebastian A, Mann N, Lindeberg S, Watkins BA et al. Origins and evolution of the western diet: health implications for the 21st century. Am J Clin Nutr 2005; 81: 341–354.
- Smith RN, Mann NJ, Braue A, Makelainen , Varigos GA. The effect of a high-protein, low glycemic-load diet versus a conventional, high glycemic-load diet on biochemical parameters associated with acne vulgaris: A randomized, investigator-masked, controlled trial. J Am Acad Dermatol 2007; 57: 247–256.
- Smith R, Mann N. Acne in adolescence: a role for nutrition? Nutr Diet 2007; 64: S147–S149.
- Cordain L. Implications for the role of diet in acne. Semin Cutan Med Surg 2005; 24: 84–91.
- Kristiansen SB, Endoh A, son PR, Buster JE, Hornsby PJ. Induction of steroidogenic enzyme genes by insulin and IGF-I in cultured adult human adrenocortical cells. Steroids 1997; 62: 258–265.
- Goodman-Gruen D, Barrett-Connor E. Sex hormone-binding globulin and glucose tolerance in postmenopausal women. the rancho bernardo study. Diabetes Care 1997; 20: 645–649.
- Powell DR, Suwanichkul A, Cubbage ML, DePaolis LA, Snuggs MB, Lee PD. Insulin inhibits transcription of the human gene for insulin-like growth factor-binding protein-1. J Biol Chem 1991; 266: 18868–18876.
- Denley A, Carroll JM, Brierley GV, Cosgrove L, Wallace J, Forbes B et al. Differential activation of insulin receptor substrates 1 and 2 by insulin-like growth factor-activated insulin receptors. Mol Cell Biol 2007; 27: 3569–3577.
- Giovannucci E, Harlan DM, Archer MC, Bergenstal RM, Gapstur SM, Habel LA et al. Diabetes and cancer: a consensus report. CA Cancer J Clin 2010; 60: 207–221.
- Rose DP, Vona-Davis L. The cellular and molecular mechanisms by which insulin influences breast cancer risk and progression. Endocr Relat Cancer 2012; 19: R225–R241.
- Renehan AG, Frystyk J, Flyvbjerg A. Obesity and cancer risk: the role of the insulin-IGF axis. Trends Endocrinol Metab 2006; 17: 328–336.
- AA.VV. Research in cancer. Science 1925; 62, x+xii+xiv.
- Warburg O, Wind F, Negelein E. The metabolism of tumors in the body. J Gen Physiol 1927; 8: 519–530.
- Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell 2011; 144: 646–674.
- Warburg O. On respiratory impairment in cancer cells. Science 1956; 124: 269–270.
- Pelicano , Xu RH, Du M, Feng L, Sasaki R, Carew JS et al. Mitochondrial respiration defects in cancer cells cause activation of akt survival pathway through a redox-mediated mechanism. J Cell Biol 2006; 175: 913–923.
- Sandri M, Barberi L, Bijlsma AY, Blaauw B, Dyar KA, Milan G et al. Signalling pathways regulating muscle mass in ageing skeletal muscle. the role of the IGF1-akt-mTOR-FoxO pathway. Biogerontology 2013;, e-pub ahead of print 19 May 2013.
- Schwertfeger KL, McManaman JL, Palmer CA, Neville MC, Anderson SM. Expression of constitutively activated akt in the mammary gland leads to excess lipid synthesis during pregnancy and lactation. J Lipid Res 2003; 44: 1100–1112.
- Klement RJ, Kammerer U. Is there a role for carbohydrate restriction in the treatment and prevention of cancer? Nutr Metab (Lond) 2011; 8: 75.
- Tisdale MJ, Brennan RA, Fearon KC. Reduction of weight loss and tumour size in a cachexia model by a high fat diet. Br J Cancer 1987; 56: 39–43.
- Beck SA, Tisdale MJ. Effect of insulin on weight loss and tumour growth in a cachexia model. Br J Cancer 1989; 59: 677–681.
- Ho VW, Leung K, Hsu A, Luk B, Lai J, Shen SY et al. A low carbohydrate, high protein diet slows tumor growth and prevents cancer initiation. Cancer Res 2011; 71: 4484–4493.
- Otto C, Kaemmerer U, Illert B, Muehling B, Pfetzer N, Wittig R et al. Growth of human gastric cancer cells in nude mice is delayed by a ketogenic diet supplemented with omega-3 fatty acids and medium-chain triglycerides. BMC Cancer 2008; 8: 122.
- Seyfried BT, Kiebish M, Marsh J, Mukherjee P. Targeting energy metabolism in brain cancer through calorie restriction and the ketogenic diet. J Cancer Res Ther 2009; 5 (Suppl 1), S7–S15.
- Zhou , Mukherjee P, Kiebish MA, Markis WT, Mantis JG, Seyfried TN. The calorically restricted ketogenic diet, an effective alternative therapy for malignant brain cancer. Nutr Metab (Lond) 2007; 4: 5.
- Schmidt M, Pfetzer N, Schwab M, Strauss I, Kammerer U. Effects of a ketogenic diet on the quality of life in 16 patients with advanced cancer: a pilot trial. Nutr Metab (Lond) 2011; 8: 54.
- Nebeling LC, Lerner E. Implementing a ketogenic diet based on medium-chain triglyceride oil in pediatric patients with cancer. J Am Diet Assoc 1995; 95: 693–697.
- Nebeling LC, Miraldi F, Shurin SB, Lerner E. Effects of a ketogenic diet on tumor metabolism and nutritional status in pediatric oncology patients: Two e reports. J Am Coll Nutr 1995; 14: 202–208.
- Fine EJ, Segal-Isaacson CJ, Feinman RD, Herszkopf S, Romano MC, Tomuta N et al. Targeting insulin inhibition as a metabolic therapy in advanced cancer: a pilot safety and feasibility dietary trial in 10 patients. Nutrition 2012; 28: 1028–1035.
- Fauser BC, Tarlatzis BC, Rebar RW, Legro RS, Balen AH, Lobo R et al. Consensus on women’s health aspects of polycystic ovary syndrome (PCOS): the amsterdam ESHRE/ASRM-sponsored 3rd PCOS consensus workshop group. Fertil Steril 2012; 97: 28–38. . e25.
- DeUgarte CM, Bartolucci AA, Azziz R. Prevalence of insulin resistance in the polycystic ovary syndrome using the homeostasis model assessment. Fertil Steril 2005; 83: 1454–1460.
- Tosi F, Negri C, Perrone F, Dorizzi R, tello R, Bonora E et al. Hyperinsulinemia amplifies GnRH agonist stimulated ovarian steroid secretion in women with polycystic ovary syndrome. J Clin Endocrinol Metab 2012; 97: 1712–1719.
- Blank SK, McCartney CR, Chhabra S, Helm KD, Eagleson CA, Chang RJ et al. Modulation of gonadotropin-releasing hormone pulse generator sensitivity to progesterone inhibition in hyperandrogenic adolescent girls–implications for regulation of pubertal maturation. J Clin Endocrinol Metab 2009; 94: 2360–2366.
- Moghetti P, tello R, Negri C, Tosi F, Spiazzi GG, Brun E et al. Insulin infusion amplifies 17 alpha-hydroxycorticosteroid intermediates response to adrenocorticotropin in hyperandrogenic women: apparent relative impairment of 17,20-lyase activity. J Clin Endocrinol Metab 1996; 81: 881–886.
- Mavropoulos JC, Yancy WS, Hepburn J, Westman EC. The effects of a low-carbohydrate, ketogenic diet on the polycystic ovary syndrome: a pilot study. Nutr Metab (Lond) 2005; 2: 35.
- Baranano KW, Hartman AL. The ketogenic diet: uses in epilepsy and other neurologic illnesses. Curr Treat Options Neurol 2008; 10: 410–419.
- Stafstrom CE, Rho JM. The ketogenic diet as a treatment paradigm for diverse neurological disorders. Front Pharmacol 2012; 3: 59.
- Bough KJ, Rho JM. Anticonvulsant mechanisms of the ketogenic diet. Epilepsia 2007; 48: 43–58.
- Huffman J, Kossoff EH. State of the ketogenic diet(s) in epilepsy. Curr Neurol Neurosci Rep 2006; 6: 332–340.
- Garriga-Canut M, Schoenike B, Qazi R, Bergendahl K, Daley TJ, Pfender RM et al. 2-deoxy-D-glucose reduces epilepsy progression by NRSF-CtBP-dependent metabolic regulation of chromatin structure. Nat Neurosci 2006; 9: 1382–1387.
- Maalouf M, Rho JM, Mattson MP. The neuroprotective properties of calorie restriction, the ketogenic diet, and ketone bodies. Brain Res Rev 2009; 59: 293–315.
- Palop JJ, Mucke L. Epilepsy and cognitive impairments in alzheimer disease. Arch Neurol 2009; 66: 435–440.
- Roberson ED, Halabisky B, Yoo JW, Yao J, Chin J, Yan F et al. Amyloid-beta/fyn-induced synaptic, network, and cognitive impairments depend on tau levels in multiple mouse models of alzheimer’s disease. J Neurosci 2011; 31: 700–711.
- Noebels J. A perfect storm: converging paths of epilepsy and alzheimer’s dementia intersect in the hippocampal formation. Epilepsia 2011; 52 (Suppl 1), 39–46.
- Kapogiannis D, Mattson MP. Disrupted energy metabolism and neuronal circuit dysfunction in cognitive impairment and alzheimer’s disease. Lancet Neurol 2011; 10: 187–198.
- Henderson ST, Vogel JL, Barr LJ, Garvin F, Jones JJ, Costantini LC. Study of the ketogenic agent AC-1202 in mild to moderate alzheimer’s disease: A randomized, double-blind, placebo-controlled, multicenter trial. Nutr Metab (Lond) 2009; 6: 31.
- Kashiwaya , Takeshima T, Mori N, Nakashima K, Clarke K, Veech RL. D-beta-hydroxybutyrate protects neurons in models of Alzheimer’s and Parkinson’s disease. Proc Natl Acad Sci USA 2000; 97: 5440–5444.
- Van der Auwera I, Wera S, Van Leuven F, Henderson ST. A ketogenic diet reduces amyloid beta 40 and 42 in a mouse model of alzheimer’s disease. Nutr Metab (Lond) 2005; 2: 28.
- Vanitallie TB, Nonas C, Di Rocco A, Boyar K, Hyams K, Heymsfield SB. Treatment of parkinson disease with diet-induced hyperketonemia: a feasibility study. Neurology 2005; 64: 728–730.
- Prins ML, Fujima LS, Hovda DA. Age-dependent reduction of cortical contusion volume by ketones after traumatic brain injury. J Neurosci Res 2005; 82: 413–420.
- Appelberg KS, Hovda DA, Prins ML. The effects of a ketogenic diet on behavioral outcome after controlled cortical impact injury in the juvenile and adult rat. J Neurotrauma 2009; 26: 497–506.
- Schwartzkroin PA, Wenzel HJ, Lyeth BG, Poon CC, Delance A, Van KC et al. Does ketogenic diet alter seizure sensitivity and cell loss following fluid percussion injury? Epilepsy Res 2010; 92: 74–84.
- Siva N. Can ketogenic diet slow progression of ALS? Lancet Neurol 2006; 5: 476.
- Zhao Z, Lange DJ, Voustianiouk A, MacGrogan D, Ho L, Suh J et al. A ketogenic diet as a potential novel therapeutic intervention in amyotrophic lateral sclerosis. BMC Neurosci 2006; 7: 29.
- Tagliabue A, Bertoli S, Trentani C, Borrelli P, Veggiotti P. Effects of the ketogenic diet on nutritional status, resting energy expenditure, and substrate oxidation in patients with medically refractory epilepsy: A 6-month prospective observational study. Clin Nutr 2012; 31: 246–249.
- Sabapathy S, Morris NR, Schneider DA. Ventilatory and gas-exchange responses to incremental exercise performed with reduced muscle glycogen content. J Sci Med Sport 2006; 9: 267–273.
- Jia , Hwang SY, House JD, Ogborn MR, Weiler HA, O K et al. Long-term high intake of whole proteins results in renal damage in pigs. J Nutr 2010; 140: 1646–1652.
- Wakefield AP, House JD, Ogborn MR, Weiler HA, Aukema HM. A diet with 35% of energy from protein leads to kidney damage in female sprague-dawley rats. Br J Nutr 2011; 1–8.
- Skov AR, Haulrik N, Toubro S, Molgaard C, Astrup A. Effect of protein intake on bone mineralization during weight loss: A 6-month trial. Obes Res 2002; 10: 432–438.
- Martin WF, Armstrong LE, Rodriguez NR. Dietary protein intake and renal function. Nutr Metab (Lond) 2005; 2: 25.
- Welle S, Nair KS. Relationship of resting metabolic rate to body composition and protein turnover. Am J Physiol 1990; 258: E990–E998.
- Praga M. Synergy of low nephron number and obesity: A new focus on hyperfiltration nephropathy. Nephrol Dial Transplant 2005; 20: 2594–2597.
- Eisenstein J, Roberts SB, Dallal G, Saltzman E. High-protein weight-loss diets: are they safe and do they work? A review of the experimental and epidemiologic data. Nutr Rev 2002; 60: 189–200.
- Westerterp-Plantenga MS. How are normal, high- or low-protein diets defined? Br J Nutr 2007; 97: 217–218.
- Pijls LT, de Vries , Donker AJ, van Eijk JT. The effect of protein restriction on albuminuria in patients with type 2 diabetes mellitus: A randomized trial. Nephrol Dial Transplant 1999; 14: 1445–1453.
- Pijls LT, de Vries , van Eijk JT, Donker AJ. Protein restriction, glomerular filtration rate and albuminuria in patients with type 2 diabetes mellitus: a randomized trial. Eur J Clin Nutr 2002; 56: 1200–1207.
- Poplawski MM, Mastaitis JW, Isoda F, Grosjean F, Zheng F, Mobbs CV. Reversal of diabetic nephropathy by a ketogenic diet. PLoS One 2011; 6: e18604.
- Johri A1, Beal MF. Mitochondrial dysfunction in neurodegenerative diseases. J Pharmacol Exp Ther. 2012 Sep;342(3):619-30.
- Hite AH1, Berkowitz VG, Berkowitz K. Low-carbohydrate diet review: shifting the paradigm. Nutr Clin Pract. 2011 Jun;26 (3):300-8.
- Puig JG1, Martínez MA. Hyperuricemia, gout and the metabolic syndrome. Curr Opin Rheumatol. 2008 Mar;20(2):187-91
- Curr Opin Rheumatol. 2008 Mar;20 (2):187-91. The great cholesterol myth; unfortunate consequences of Brown and Goldstein’s mistake. QJM. 2011 Oct;104(10):867-70.
- Siri-Tarino PW1, Sun Q, Hu FB, Krauss RM. Meta-analysis of prospective cohort studies evaluating the association of saturated fat with cardiovascular disease. Am J Clin Nutr. 2010 Mar;91(3):535-46.
- Gano LB1, Patel M1, Rho JM2. Ketogenic diets, mitochondria, and neurological diseases. J Lipid Res. 2014 Nov;55(11):2211-28
- Woolf EC1, Scheck AC1 The ketogenic diet for the treatment of malignant glioma. J Lipid Res. 2015 Jan;56(1):5-10




